Różne oblicza metabolizmu leków
21.06.2013
Większość metabolizowanych leków jest przekształcana do nieaktywnych substancji, pozostałe do aktywnych metabolitów, które zdolne są wywoływać określony efekt farmakologiczny,co może mieć związek z szeregiem dodatkowych korzyści.
Dla przykładu antagonista receptora H1 – feksofendyna jest aktywnym metabolitem terfenadyny. Największą zaletą jej stosowania jest fakt, iż posiada około 50 razy mniejszą tendencję niż terfenadyna do blokowania kanałów potasowych, co zmniejsza prawdopodobieństwo wystąpienia niebezpiecznego dla życia torsade de pointes przy jednoczesnym zachowaniu jej skuteczności jako leku przeciwalergicznego.
Innym przykładem jest kodeina, która w ok. 15% przy udziale CYP2D6 metabolizowana jest do morfiny – posiadającej ok. 200 razy większe powinowactwo do receptora mi niż sama kodeina.
Nowoczesny kortykosteroid – cyklezonid, stosowany w postaci aerozolu przekształcany zostaje w aktywny metabolit dopiero w nabłonku dróg oddechowych, co istotnie zmniejsza ilość działań niepożądanych charakterystycznych dla tradycyjnych wziewnych kortykosteroidów.
Niestety w niektórych przypadkach metabolity mogą wykazywać działania, które nie są obserwowane u związków pierwotnych np. mogą charakteryzować się dużą toksycznością.
Pod wpływem metabolizmu – N- demetylacji petydyny powstaje charakteryzująca się działaniem neurotoksycznym norpetydyna, która jest odpowiedzialna za szereg działań niepożądanych ze strony ośrodkowego układu nerwowego takich jak: zaburzenia świadomości, drżenia, drgawki, halucynacje.
Gdy z jakiegoś powodu dochodzi do zahamowania metabolizmu z jednej strony możemy się spodziewać ryzyka niebezpiecznej kumulacji leku, który zwyczajnie nie może zostać unieczynniony, a z drugiej z ryzykiem braku efektu terapeutycznego – jeśli mamy do czynienia z lekiem, który dopiero na skutek metabolizmu zostaje aktywowany.
Podobnie indukcja przez jeden lek enzymów metabolizujących, w zależności od nasilenia, może prowadzić do braku efektu terapeutycznego innego leku.
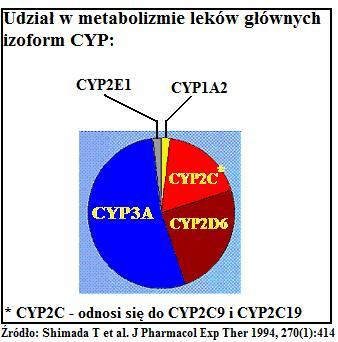
Największą i najistotniejszą w metabolizmie leków (procesy oksydacji) grupę enzymów mikrosomalnych wątroby stanowi rodzina cytochromu P450, której zadaniem jest przygotować silnie litofilną substancję do drugiego etapu metabolizmu. Istnieje wiele izoform cytochromu, jednak w świetle współczesnej wiedzy, największy udział w metabolizmie leków przypisuje się:
- CYP3A
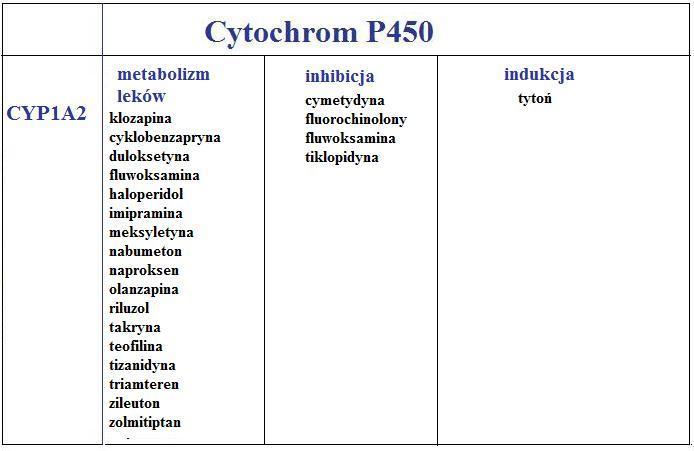
- CYP1A2
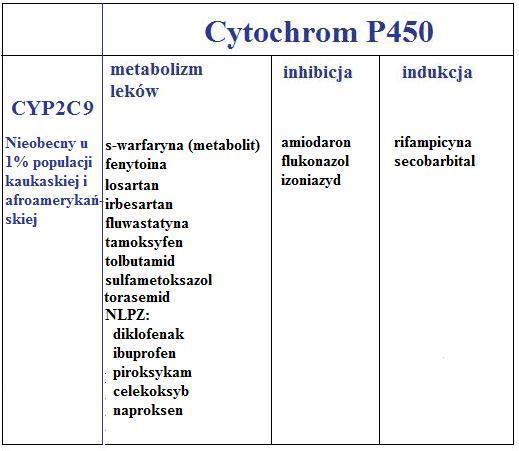
- CYP2C9
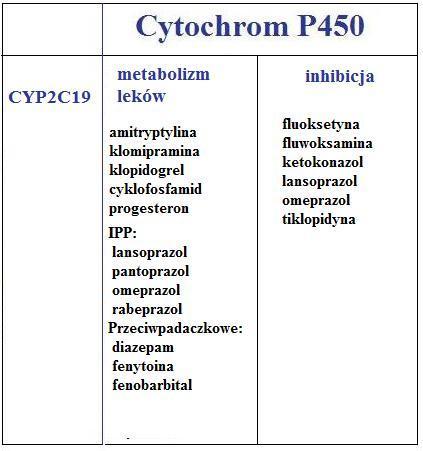
- CYP2C19
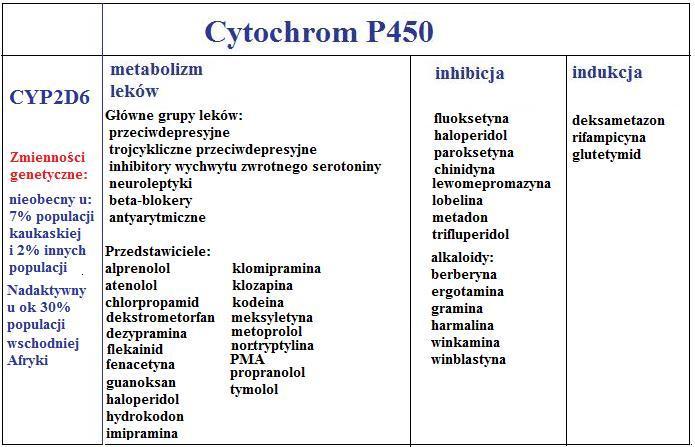
- CYP2D6
Cytochromy P450 obecne są przede wszystkim w wątrobie, ale także w ścianie jelit, co z klinicznego punktu widzenia ma istotne znaczenie. W przypadku pacjentów, u których z jakiegoś powodu dochodzi do upośledzenia wchłaniania leków np. w wyniku zwolnionego pasażu jelitowego dowiedziono, że np. efekt terapeutyczny chloropromazyny będzie znacznie osłabiony, a lewodopy całkowicie zniesiony.
Ponadto choroby wątroby mogą wywierać wpływ na aktywność poszczególnych izoenzymów cytochromu. Stwierdzono znaczną wrażliwość CYP3A na zmiany patologiczne w tkance wątrobowej. Ponadto już niewielki stopień niewydolności tego narządu może prowadzić do upośledzenia eliminacji metabolizowanych leków. Z tego względu w chorobach wątroby należy rozpoczynać leczenie od małych dawek i jeśli istnieje taka możliwość monitorować ich stężenie we krwi.
Różnice w szybkości lub stopniu metabolizmu leków przy udziale CYP mogą być przyczyną genetycznego polimorfizmu. Zauważalna jest duża zmienność osobnicza w zakresie ekspresji cytochromu, np. u niektórych osób CYP2D6 może w ogóle nie występować. Ponadto istotne klinicznie jest, czy dany lek wykazuje tendencje to indukowania lub hamowania danego CYP, co przekładać się będzie na zaburzenia w metabolizmie leków będących substratami danego izoenzymu. Warto także dodać, że niektóre substancje np. karbamazepina lub kofeina mogą indukować swój własny metabolizm.
Inhibitory określonego CYP mogą, ale nie muszą być przez niego metabolizowane np. erytromycyna jest zarówno substratem jak i inhibitorem CYP3A4, natomiast chinidyna jest silnym inhibitorem CYP2D6, choć jej własny metabolizm zależny jest od CYP3A4.
Najczęściej mamy do czynienia z kompetycyjnym hamowaniem aktywności enzymów, wówczas ich normalizacja będzie możliwa w chwili, w której lek-inhibitor zostanie wydalony z organizmu – 4-7 okresów półtrwania.
CYP3A
Rodzina CYP3A odpowiedzialna jest za metabolizm „pierwszego przejścia” do 60% wszystkich leków. Obecna przede wszystkim w wątrobie, ale także w ścianie jelit, co sprawia, że w przypadku przyjęcia doustnego, leki (substraty) ulegają w pewnym stopniu metabolizmowi już w przewodzie pokarmowym przed wchłonięciem do krążenia.
Enzymy CYP3A związane są z czterema genami: CYP3A3, CYP3A4, CYP3A5 i CYP3A7, które zlokalizowane są na 7 chromosomie, najważniejsze znaczenie mają izoenzymy CYP3A4 oraz CYP3A5.
Polimorfizm w obrębie genów kodujących izoenzymy z rodziny CYP3A może przekładać się na farmakokinetykę metabolizowanych przez nie leków. Jak wykazali badacze [Sata F. et al.* ] w przypadku polimorfizmu w obrębie genu kodującego CYP3A4 stosowanie silnego antagonisty wapnia – nifedipiny, (która jest metabolizowana przez CYP3A4) powoduje obniżenie jej Vmax o 36%.
Znaczenie kliniczne ma także możliwość wchodzenia w interakcje leków będących substratami CYP3A z inhibitorem lub lekiem indukującym CYP3A. Ryzykowne może być np. stosowanie simwastatyny, która jest metabolizowana wyłącznie przy udziale CYP3A4 z silnym inhibitorem tego enzymu – werapamilem, stwarzając ryzyko miopatii i rabdomiolizy.
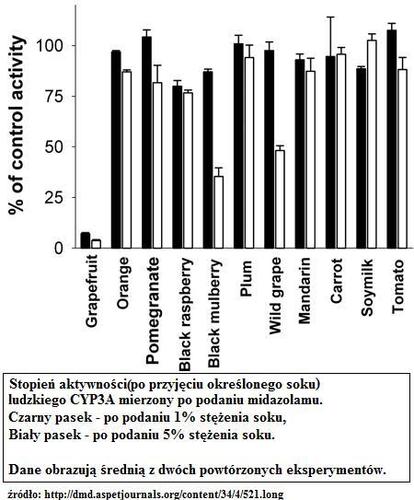
Grejpfrut, który powszechnie znany jest jako inhibitor CYP3A4 może stwarzać ryzyko toksyczności leków metabolizowanych przez ten izoenzym, za sprawą zmniejszonego ich metabolizmu. Podobnie w przypadku niektórych innych owoców i warzyw.Przykłady innych leków będących substratami, inhibitorami lub induktorami określonego izoenzymu CYP zostały przedstawione poniżej. Ich znajomość może mieć kluczowe znaczenie w celu uniknięcia często niebezpiecznych interakcji lekowych.
* Sata F, Sapone A, Elizondo G, et al. CYP3A4 allelic variants with amino acid substitutions in exons 7 and 12: evidence for an alleli variant with altered catalytic activity. Clin Pharmacol Ther 2000; 67: 48-56.
Autor: Daria Schetz